martes, 26 de noviembre de 2013
martes, 12 de noviembre de 2013
Química General
QUÍMICA GENERAL
Estudia los fenómenos comunes a toda la materia, sus propiedades y leyes. Ciencia experimental que se ocupa de las transformaciones de unas sustancias en otras sin que se alteren los elementos que las integran.
MATERIA
Materia es todo aquello que tiene localización espacial, posee una cierta cantidad de energía, y está sujeto a cambios en el tiempo y a interacciones con aparatos de medida.
MEZCLA
Una mezcla es un sistema material formado por dos o más componentes mezclados, pero no combinados químicamente. En una mezcla no ocurre una reacción química y cada uno de sus componentes mantiene su identidad y propiedades químicas. No obstante, algunas mezclas pueden ser reactivas, es decir, que sus componentes pueden reaccionar entre sí en determinadas condiciones ambientales, como una mezcla aire-combustible en un motor de combustión interna.
Mezclas homogéneas : Aquellas mezclas que sus componentes no se pueden diferenciar a simple vista. Las mezclas homogéneas de líquidos se conocen con el nombre de disoluciones y están constituidas por un soluto y un disolvente, siendo el primero el que se encuentra en menor proporción y además suele ser el líquido. Por ejemplo, el agua mezclada con sales minerales o con azúcar, el agua es el disolvente y el azúcar el soluto.
Mezclas heterogéneas o no uniformes son aquellas en las que la composición de la muestra varía de un punto a otro. Muchas rocas pertenecen a esta categoría. En un trozo de granito se pueden distinguir varios componentes, que se diferencian entre ellos por el color.
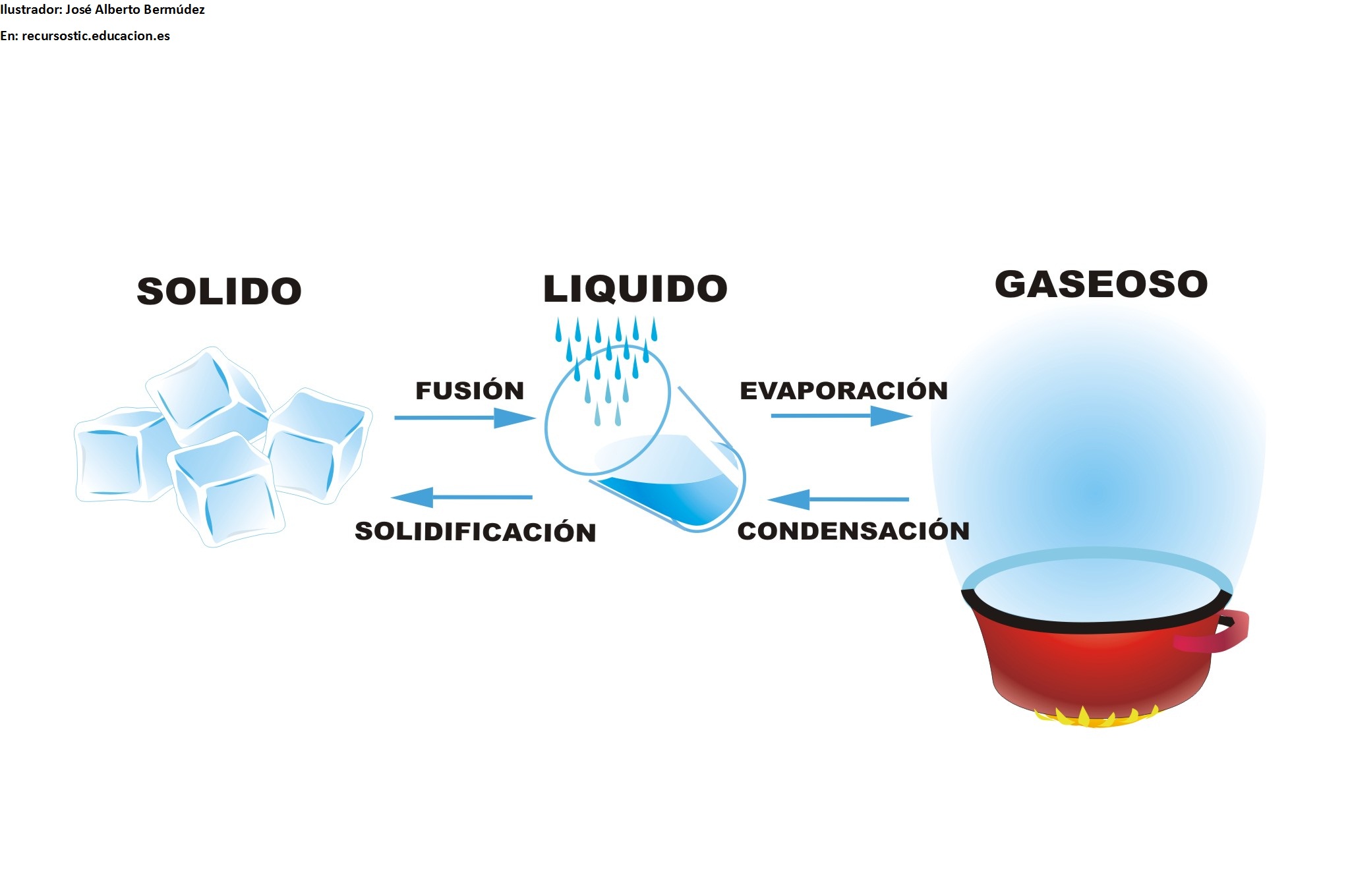
ESTADOS DE LA MATERIA
La materia se presenta en tres estados o formas de agregación: sólido, líquido y gaseoso.
Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua.
La mayoría de sustancias se presentan en un estado concreto. Así, los metales o las sustancias que constituyen los minerales se encuentran en estado sólido y el oxígeno o el CO2 en estado gaseoso:
•Los sólidos: Tienen forma y volumen constantes. Se caracterizan por la rigidez y regularidad de sus estructuras.
•Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
•Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión.
Plasma
Existe un cuarto estado de la materia llamado plasma, que se forman bajo temperaturas y presiones extremadamente altas, haciendo que los impactos entre los electrones sean muy violentos, separándose del núcleo y dejando sólo átomos dispersos.El plasma, es así, una mezcla de núcleos positivos y electrones libres, que tiene la capacidad de conducir electricidad.
ELEMENTO QUÍMICO
Un elemento químico es un tipo de materia constituida por átomos de la misma clase. En su forma más simple posee un número determinado de protones en su núcleo, haciéndolo pertenecer a una categoría única clasificada con el número atómico, aun cuando este pueda desplegar distintas masas atómicas. Es un átomo con características físicas únicas, aquella sustancia que no puede ser descompuesta mediante unareacción química, en otras más simples. No existen dos átomos de un mismo elemento con características distintas y, en el caso de que estos posean número másico distinto, pertenecen al mismo elemento pero en lo que se conoce como uno de sus isótopos. También es importante diferenciar entre un «elementos químicos» de una sustancia simple. Los elementos se encuentran en la tabla periódica de los elementos.
ALOTROPO
Los átomos de elementos puros pueden enlace químico entre sí en más de una vía, permitiendo que el elemento puro que existe en las estructuras múltiples (arreglos espaciales de los átomos), conocida como alótropos, que se diferencian en sus propiedades. Por ejemplo, el carbono se puede encontrar como el diamante, que tiene una estructura tetraédrica alrededor de cada átomo de carbono, grafito, que tiene capas de átomos de carbono con una estructura hexagonal apilados uno encima del otro;
PROPIEDADES DE LA MATERIA
Las propiedades de la materia son útiles a la hora de distinguir entre las diferentes sustancias. Estas propiedades se clasifican tanto en físicas como en químicas.
Físicas:
Las propiedades físicas, son aquellas que pueden observarse o medirse sin variar la composición ni la estructura de cierta sustancia; como por ejemplo el color, el olor y la densidad.
• Textura: Propiedad que tienen las partes externas de los objetos como así mismo las sensaciones que estos han de causar.
• Color, olor y sabor: Son características que hacen que las sustancias sean fáciles de distinguir.
• Dureza: Propiedad de los materiales a la penetración, absorción, rayado, etc. O es la cantidad de energía que ha de absorberse un material ante un esfuerzo, esto antes de romperse
• Viscosidad: Opción de un fluido a las deformaciones tangenciales.
• Ductibilidad: Capacidad de un material a resistir a una deformación sin sufrir rotura.
• Tenacidad: Capacidad que ha de tener un material para almacenar energía, en forma de deformación plástica.
• Densidad: magnitud escalar, la cual hace referencia a la cantidad de masa contenida en un determinado volumen de una sustancia.
Químicas:
Las propiedades químicas involucran cambios en la composición y en la estructura, que ocurren cuando la sustancia se somete a diferentes condiciones.
• Inflamabilidad: Propiedad química, para determinara es necesario someter a una sustancia a la combustión; al hacerlo, cambia la composición y se transforma en nuevas sustancias.
• Combustión: Reacción de oxidación, en la cual se desprende una cantidad de calor y luz (fuego).
• Fotosíntesis: Conversión de la materia inorgánica a materia orgánica gracias a la energía que ha de aportar la luz.
• Respiración: Es la entrada de oxígeno al cuerpo de un ser vivo y la salida de oxido de carbono.
• Reactividad: Es la capacidad de reacción química que presenta ante otros reactivos una sustancia (termodinámica y cinética).
• Acidez: la acidez de una sustancia es el grado en el cual es ácida.
• Poder calorífico: Es la cantidad de energía que la unidad de masa puede llegar a desprender; siempre y cuando se halla producido una oxidación.
MÉTODOS DE SEPARACIÓN DE MEZCLAS
DECANTACIÓN: Es la separación mecánica de un sólido de grano grueso, insoluble, en un líquido; consiste en verter cuidadosamente el líquido, después de que se ha sedimentado el sólido. Por este proceso se separan dos líquidos miscibles, de diferente densidad, por ejemplo, agua y aceite.
FILTRACIÓN: Es un tipo de separación mecánica, que sirve para separar sólidos insolubles de grano fino de un líquido en el cual se encuentran mezclados; este método consiste en verter la mezcla a través de un medio poroso que deje pasar el líquido y retenga el sólido. Los aparatos usados se llaman filtros; el más común es el de porcelana porosa, usado en los hogares para purificar el agua. Los medios más porosos mas usados son: el papel filtro, la fibra de vidrio o asbesto, telas etc.
En el laboratorio se usa el papel filtro, que se coloca en forma de cono en un embudo de vidrio, a través del cual se hace pasar la mezcla, reteniendo el filtro la parte sólida y dejando pasar el líquido
EVAPORACIÓN: Es la separación de un sólido disuelto en un líquido, por calentamiento, hasta que hierve y se transforma en vapor. Como no todas las sustancias se evaporan con la misma rapidez, el sólido disuelto se obtiene en forma pura.
DESTILACIÓN: Es el proceso mediante el cual se efectúa la separación de dos o más líquidos miscibles y consiste en un a evaporación y condensación sucesivas, aprovechando los diferentes puntos de ebullición de cada uno de los líquidos, también se emplea para purificar un liquido eliminando sus impurezas.
En la industria, la destilación se efectúa por medio de alambiques, que constan de caldera o retorta, el refrigerante en forma de serpentín y el recolector; mediante este procedimiento se obtiene el agua destilada o bidestilada, usada en las ámpulas o ampolletas que se usan para preparar las suspensiones de los antibióticos, así como el agua destilada para las planchas de vapor; también de esta manera se obtiene la purificación del alcohol, la destilación del petróleo, etc.
CENTRIFUGACIÓN: Proceso mecánico que permite, por medio de un movimiento acelerado de rotación, provocar la sedimentación de los componentes de una mezcla con diferente densidad. Para ello se usa una máquina especial llamada centrífuga. Ejemplo: se pueden separar las grasas mezcladas en los líquidos, como la leche, o bien los paquetes celulares de la sangre, separándolos del suero sanguíneo.
CRISTALIZACIÓN: Separación de un sólido soluble y la solución que lo contiene, en forma de cristales. Los cristales pueden formarse de tres maneras:
Por fusión: para cristalizar una sustancia como el azufre por este procedimiento, se coloca el azufre en un crisol y se funde por calentamiento, se enfría y cuando se ha formado una costra en la superficie, se hace un agujero en ella y se invierte bruscamente el crisol, vertiendo el líquido que queda dentro. Se observará una hermosa malla de cristales en el interior del crisol.
Por disolución: Consiste en saturar un líquido o disolvente, por medio de un sólido o soluto y dejar que se vaya evaporando lentamente, hasta que se han formado los cristales. También puede hacerse una disolución concentrada en caliente y dejarla enfriar. Si el enfriamiento es rápido, se obtendrán cristales pequeños, y si es lento, cristales grandes.
Sublimación: Es el paso directo de un sólido gas, como sucede con el Iodo y la naftalina al ser calentados, ya que al enfriarse, los gases originan la cristalización por enfriamiento rápido.
CROMATOGRAFÍA: Es un procedimiento para separar, identificar y determinar con exactitud la cantidad de cada uno de los componentes de una mezcla.
lunes, 11 de noviembre de 2013
Suscribirse a:
Entradas (Atom)